As Exemplos De Teoria Ácido-Base De Brønsted-Lowry assumem protagonismo, esta passagem inicial convida os leitores a um mundo criado com conhecimento profundo, garantindo uma experiência de leitura absorvente e distintamente original.
O conteúdo do segundo parágrafo fornece informações descritivas e claras sobre o tema
Definição da Teoria de Brønsted-Lowry
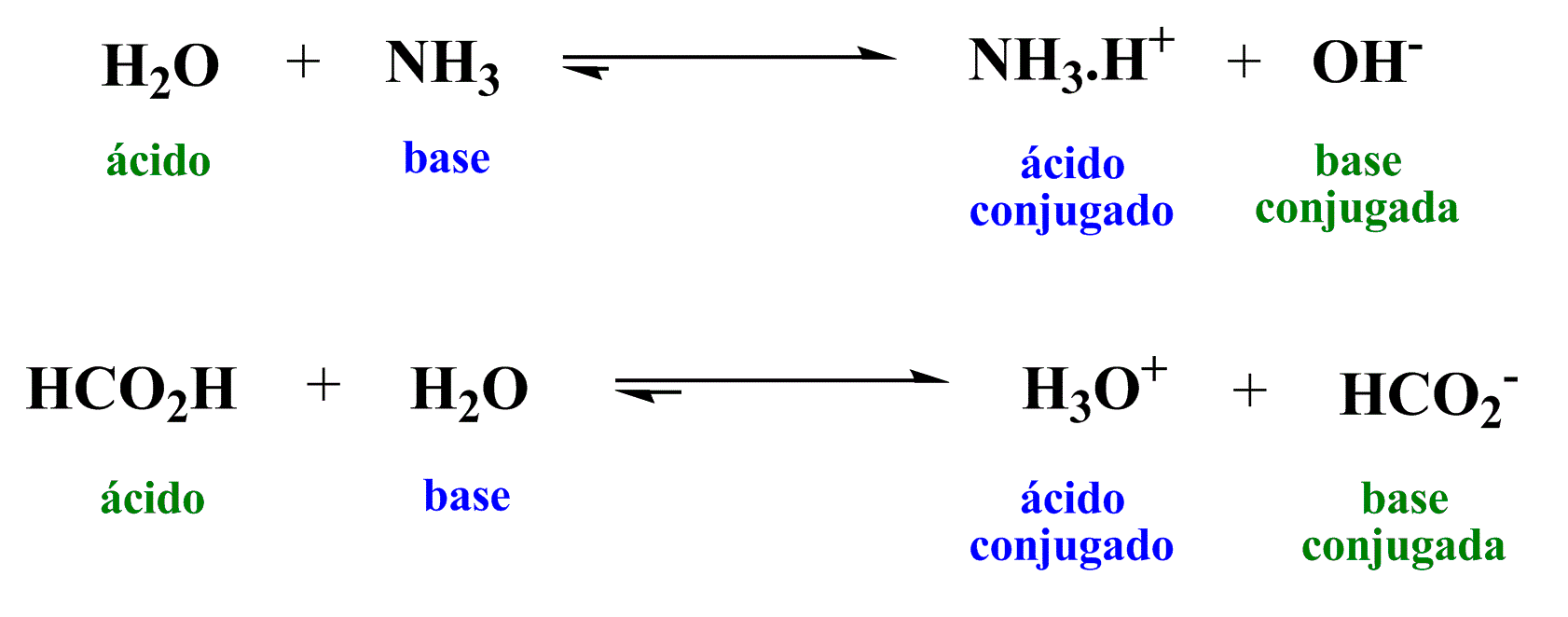
A Teoria de Brønsted-Lowry define ácidos e bases com base na transferência de prótons. De acordo com essa teoria, um ácido é uma substância que pode doar um próton (íon H+), enquanto uma base é uma substância que pode receber um próton.
Quando um ácido doa um próton, ele se torna uma base conjugada. Por outro lado, quando uma base recebe um próton, ela se torna um ácido conjugado.
Reações Ácido-Base
As reações ácido-base envolvem a transferência de prótons entre ácidos e bases. Essas reações são geralmente representadas por equações químicas que mostram a transferência de um próton de um ácido para uma base.
Por exemplo, na reação entre o ácido clorídrico (HCl) e o hidróxido de sódio (NaOH), o HCl doa um próton para o NaOH, resultando na formação de cloreto de sódio (NaCl) e água (H 2O):
HCl + NaOH → NaCl + H2O
Propriedades dos Ácidos e Bases
Ácidos e bases são substâncias químicas que exibem propriedades distintas e características opostas. As suas propriedades dependem da sua força, que pode ser classificada como forte ou fraca.
Ácidos Fortes
Os ácidos fortes são substâncias que ionizam completamente em água, libertando todos os seus iões H+. São altamente corrosivos e reagem rapidamente com bases para formar sais. Alguns exemplos de ácidos fortes incluem:
- Ácido clorídrico (HCl)
- Ácido sulfúrico (H 2SO 4)
- Ácido nítrico (HNO 3)
Ácidos Fracos
Os ácidos fracos ionizam-se parcialmente em água, libertando apenas uma pequena fração dos seus iões H+. São menos corrosivos do que os ácidos fortes e reagem mais lentamente com bases. Alguns exemplos de ácidos fracos incluem:
- Ácido acético (CH 3COOH)
- Ácido carbónico (H 2CO 3)
- Ácido fosfórico (H 3PO 4)
Bases Fortes
As bases fortes são substâncias que ionizam completamente em água, libertando todos os seus iões OH-. São escorregadias ao toque e reagem rapidamente com ácidos para formar sais. Alguns exemplos de bases fortes incluem:
- Hidróxido de sódio (NaOH)
- Hidróxido de potássio (KOH)
- Hidróxido de cálcio (Ca(OH) 2)
Bases fracas
As bases fracas ionizam-se parcialmente em água, libertando apenas uma pequena fração dos seus iões OH-. São menos escorregadias ao toque do que as bases fortes e reagem mais lentamente com ácidos. Alguns exemplos de bases fracas incluem:
- Amoníaco (NH 3)
- Bicarbonato de sódio (NaHCO 3)
- Carbonato de cálcio (CaCO 3)
Reações de Neutralização: Exemplos De Teoria Ácido-Base De Brønsted-Lowry

Reações de neutralização são reações químicas entre ácidos e bases que resultam na formação de um sal e água. Essas reações são importantes em vários processos químicos, como titulação e controle de pH.
O processo de neutralização envolve a transferência de um próton (H+) do ácido para a base. O ácido doa um próton, tornando-se uma base conjugada, enquanto a base aceita um próton, tornando-se um ácido conjugado.
Equações Químicas Balanceadas
As equações químicas balanceadas para reações de neutralização podem ser representadas na forma geral:
Ácido + Base → Sal + Água
Por exemplo, a reação de neutralização entre ácido clorídrico (HCl) e hidróxido de sódio (NaOH) pode ser escrita como:
HCl + NaOH → NaCl + H2O
Tabela de Exemplos de Reações de Neutralização, Exemplos De Teoria Ácido-Base De Brønsted-Lowry
A seguir está uma tabela com exemplos comuns de reações de neutralização:
| Ácido | Base | Sal | Água |
|---|---|---|---|
| Ácido clorídrico (HCl) | Hidróxido de sódio (NaOH) | Cloreto de sódio (NaCl) | H2O |
| Ácido sulfúrico (H2SO4) | Hidróxido de potássio (KOH) | Sulfato de potássio (K2SO4) | H2O |
| Ácido nítrico (HNO3) | Hidróxido de cálcio (Ca(OH)2) | Nitrato de cálcio (Ca(NO3)2) | H2O |
Aplicações da Teoria de Brønsted-Lowry
A teoria ácido-base de Brønsted-Lowry tem aplicações em diversos campos científicos, incluindo química, biologia e medicina. Esta teoria fornece uma compreensão fundamental do comportamento ácido-base e é usada para resolver uma ampla gama de problemas práticos.
Química
Em química, a teoria de Brønsted-Lowry é usada para:* Determinar a força relativa de ácidos e bases
- Prever a direção das reações ácido-base
- Projetar e sintetizar novos compostos
- Entender os mecanismos de reações químicas
Biologia
Em biologia, a teoria de Brønsted-Lowry é usada para:* Entender o equilíbrio ácido-base no sangue e outros fluidos corporais
- Explicar o funcionamento de enzimas e outras proteínas
- Compreender os processos de transporte de íons através das membranas celulares
- Estudar o metabolismo e a respiração celular
Medicina
Em medicina, a teoria de Brønsted-Lowry é usada para:* Diagnosticar e tratar distúrbios do equilíbrio ácido-base
- Desenvolver medicamentos e terapias que afetam o pH
- Entender a farmacocinética e farmacodinâmica dos medicamentos
- Projetar e otimizar dispositivos médicos, como respiradores e dialisadores
Limitações da Teoria de Brønsted-Lowry

Apesar de sua ampla aplicabilidade, a teoria de Brønsted-Lowry apresenta algumas limitações:
Subtópico
A teoria não se aplica a solventes não aquosos. Em solventes como benzeno ou diclorometano, as reações de ionização podem não ocorrer da mesma forma que em água.
Subtópico
A teoria não considera a força dos ácidos e bases. Ácidos e bases fortes ionizam-se completamente em água, enquanto ácidos e bases fracas ionizam-se apenas parcialmente. A teoria de Brønsted-Lowry não fornece uma explicação para essa diferença de força.
Subtópico
A teoria não explica a autoionização da água. A água pode atuar como ácido ou base, doando ou aceitando um próton. A teoria de Brønsted-Lowry não fornece uma explicação para esse comportamento.
Teorias Alternativas
Para superar essas limitações, foram desenvolvidas teorias alternativas que complementam ou estendem a teoria de Brønsted-Lowry:
- Teoria do Par Eletrônico de Lewis
- Teoria Ácido-Base de Lux-Flood
- Teoria Ácido-Base de Usanovich
Essas teorias fornecem explicações mais abrangentes para o comportamento ácido-base e são aplicáveis a uma gama mais ampla de sistemas.
O conteúdo do parágrafo conclusivo fornece um resumo e reflexões finais de forma envolvente

